پاتوفیزیولوژی
ژنتیک
سرطان ها در اثر یک سری جهش ایجاد می شوند. هر جهش تا حدودی رفتار سلول را تغییر می دهد. سرطان اساساً بیماری تنظیم رشد بافت است. برای اینکه یک سلول طبیعی به سلول سرطانی تبدیل شود، ژنهایی که رشد و تمایز سلولی را تنظیم میکنند باید تغییر کنند.
ژن های آسیب دیده به دو دسته کلی تقسیم می شوند. انکوژن ها ژن هایی هستند که
رشد و تکثیر سلولی را تقویت می کند. ژن های سرکوبگر تومور ژن هایی هستند که از تقسیم سلولی و بقا جلوگیری می کنند. دگرگونی بدخیم میتواند از طریق تشکیل انکوژنهای جدید، بیان بیش از حد نامناسب انکوژنهای طبیعی، یا با بیان ناکافی یا از کار انداختن ژنهای سرکوبکننده تومور رخ دهد. به طور معمول، تغییرات در چندین ژن برای تبدیل یک سلول طبیعی به سلول سرطانی مورد نیاز است.
تغییرات ژنتیکی می تواند در سطوح مختلف و با مکانیسم های مختلف رخ دهد. افزایش یا از دست دادن کل یک کروموزوم می تواند از طریق خطا در میتوز رخ دهد. شایع تر جهش ها هستند، که تغییرات در توالی نوکلئوتیدی DNA ژنومی است.
جهش در مقیاس بزرگ شامل حذف یا به دست آوردن بخشی از یک کروموزوم است. تکثیر ژنومی زمانی اتفاق میافتد که یک سلول نسخههایی (اغلب 20 یا بیشتر) از یک مکان کروموزومی کوچک به دست میآورد که معمولاً حاوی یک یا چند انکوژن و مواد ژنتیکی مجاور است. جابجایی زمانی اتفاق میافتد که دو ناحیه کروموزومی مجزا به طور غیرطبیعی و اغلب در یک مکان مشخص با هم ترکیب میشوند. یک مثال شناخته شده از این کروموزوم فیلادلفیا یا جابجایی کروموزوم های 9 و 22 است که در لوسمی میلوژن مزمن رخ می دهد و منجر به تولید پروتئین فیوژن BCR-abl، یک تیروزین کیناز انکوژن می شود.
جهشهای در مقیاس کوچک شامل جهشهای نقطهای، حذفها و درجها هستند که ممکن است در ناحیه پروموتر یک ژن رخ دهند و بر بیان آن تأثیر بگذارند یا ممکن است در توالی کدکننده ژن رخ دهند و عملکرد یا پایداری محصول پروتئینی آن را تغییر دهند. اختلال در یک ژن منفرد همچنین ممکن است در نتیجه ادغام مواد ژنومی از یک ویروس DNA یا رتروویروس باشد که منجر به بیان انکوژن های ویروسی در سلول آسیب دیده و فرزندان آن می شود.
همانندسازی داده های موجود در DNA سلول های زنده به احتمال زیاد انجام خواهد شد منجر به برخی از خطاها (جهش) می شود. تصحیح خطا و پیشگیری پیچیده ساخته شده است وارد این فرآیند شده و از سلول در برابر سرطان محافظت می کند. اگر خطای قابل توجهی رخ دهد، سلول آسیب دیده می تواند از طریق مرگ برنامه ریزی شده سلولی که آپوپتوز نامیده می شود، خود تخریب شود. اگر فرآیندهای کنترل خطا با شکست مواجه می شوند، سپس جهش ها زنده می مانند و به سلول های دختر منتقل می شوند.
برخی از محیط ها احتمال بروز و انتشار خطا را بیشتر می کنند. چنین محیط هایی می تواند شامل وجود مواد مخرب به نام سرطان زا، آسیب فیزیکی مکرر، گرما، تابش یونیزان یا هیپوکسی باشد.
خطاهایی که باعث سرطان می شوند، خود تقویت شونده و ترکیبی هستند، به عنوان مثال:
- یک جهش در دستگاه تصحیح خطای یک سلول ممکن است باعث شود آن سلول و فرزندانش سریعتر خطاها را جمع کنند.
- جهش بیشتر در یک انکوژن ممکن است باعث شود که سلول سریعتر و بیشتر از همتایان عادی خود تولید مثل کند.
- جهش بیشتر ممکن است باعث از دست دادن ژن سرکوبگر تومور شود، مسیر سیگنال دهی آپوپتوز را مختل کرده و سلول را جاودانه کند.
- یک جهش بیشتر در دستگاه سیگنال دهی سلول ممکن است سیگنال های ایجاد خطا را به سلول های مجاور ارسال کند.
تبدیل یک سلول طبیعی به سرطان شبیه به یک واکنش زنجیره ای ناشی از خطاهای اولیه است که به خطاهای شدیدتر تبدیل می شود و هر کدام به تدریج به سلول اجازه می دهد تا از کنترل های بیشتری فرار کند که رشد طبیعی بافت را محدود می کند. این سناریوی شورش مانند بقای نامطلوب ترین افراد است، جایی که نیروهای محرکه تکامل علیه طراحی بدن و اجرای نظم کار می کنند. هنگامی که سرطان شروع به رشد کرد، این فرآیند مداوم که تکامل کلونال نامیده می شود، پیشرفت را به سمت مراحل تهاجمی تر هدایت می کند. تکامل کلونال منجر به ناهمگنی درون توموری می شود (سلول های سرطانی با
جهشهای ناهمگن) که طراحی استراتژیهای درمانی مؤثر را پیچیده میکند و نیازمند یک رویکرد تکاملی برای طراحی درمان است.
توانایی های مشخصه ایجاد شده توسط سرطان ها به دسته هایی تقسیم می شوند، به ویژه فرار از آپوپتوز، خودکفایی در سیگنال های رشد، عدم حساسیت به سیگنال های ضد رشد، رگزایی پایدار، پتانسیل تکرار بی حد و حصر، متاستاز، برنامه ریزی مجدد متابولیسم انرژی و فرار از تخریب سیستم ایمنی.
اپی ژنتیک
نقش اصلی آسیب DNA و نقصهای اپی ژنتیکی در ژنهای ترمیم DNA در سرطانزایی دیدگاه کلاسیک سرطان مجموعهای از بیماریها است که ناشی از ناهنجاریهای ژنتیکی پیشرونده است که شامل جهش در ژنهای سرکوبگر تومور و انکوژنها و در ناهنجاریهای کروموزومی است. نقش تغییرات اپی ژنتیکی در اوایل قرن بیست و یکم شناسایی شد.
تغییرات اپی ژنتیکی تغییرات عملکردی مربوط به ژنوم هستند که توالی نوکلئوتیدی را تغییر نمی دهند. نمونه هایی از این تغییرات عبارتند از: تغییرات در متیلاسیون DNA (هیپر متیلاسیون و هیپومتیلاسیون)، اصلاح هیستون و تغییرات در ساختار کروموزومی (ناشی از بیان نامناسب پروتئین هایی مانند HMGA2 یا HMGA1). هر یک از این تغییرات بیان ژن را بدون تغییر توالی DNA زیرین تنظیم می کند. این تغییرات ممکن است از طریق تقسیم سلولی باقی بمانند، برای چندین نسل باقی بمانند و می توانند معادل جهش در نظر گرفته شوند.
تغییرات اپی ژنتیک اغلب در سرطان ها رخ می دهد. به عنوان مثال، یک مطالعه ژنهای کدکننده پروتئین را فهرست کرد که اغلب در متیلاسیون خود در ارتباط با سرطان روده بزرگ تغییر میکردند. این شامل 147 ژن هیپرمتیله و 27 ژن هیپومتیله بود. از میان ژنهای هیپرمتیله، 10 ژن در 100 درصد سرطانهای روده بزرگ و بسیاری دیگر در بیش از 50 درصد سرطانهای کولون هیپرمتیله شدند.
در حالی که تغییرات اپی ژنتیکی در سرطان ها یافت می شود، تغییرات اپی ژنتیکی در ژن های ترمیم DNA، که باعث کاهش بیان پروتئین های ترمیم DNA می شود، ممکن است از اهمیت ویژه ای برخوردار باشد. چنین تغییراتی ممکن است در اوایل پیشرفت سرطان رخ دهد و یکی از دلایل احتمالی بی ثباتی ژنتیکی مشخصه سرطان ها باشد.
کاهش بیان ژن های ترمیم DNA باعث اختلال در ترمیم DNA می شود. این در شکل در سطح 4 از بالا نشان داده شده است. (در شکل، عبارت قرمز نقش اصلی آسیب DNA و نقص در ترمیم DNA در پیشرفت سرطان را نشان می دهد.) هنگامی که ترمیم DNA کمبود داشته باشد، آسیب DNA در سلول ها در سطح بالاتر از حد معمول (سطح 5) باقی می ماند و باعث افزایش فراوانی جهش و/یا اپی موتاسیون (سطح ششم) می شود. نرخ جهش به طور قابل توجهی در سلول های معیوب در ترمیم عدم تطابق DNA یا در ترمیم نوترکیبی همولوگ (HRR) افزایش می یابد. بازآرایی های کروموزومی و آنیوپلوئیدی نیز در سلول های معیوب HRR افزایش می یابد.
سطوح بالاتر آسیب DNA باعث افزایش جهش (سمت راست شکل) و افزایش epimutation می شود. در طول ترمیم شکستگی های دو رشته ای DNA یا ترمیم سایر آسیب های DNA، محل های ترمیم ناقص پاک شده می توانند باعث خاموش شدن ژن اپی ژنتیک شوند.
بیان کمبود پروتئین های ترمیم DNA به دلیل جهش ارثی می تواند خطر ابتلا به سرطان را افزایش دهد. افرادی که دارای اختلال ارثی در هر یک از 34 ژن ترمیم DNA هستند (به مقاله اختلال ترمیم-کمبود DNA مراجعه کنید) خطر ابتلا به سرطان را افزایش داده اند، با برخی از نقایص که 100٪ شانس ابتلا به سرطان را تضمین می کند (مانند جهش p53). جهش های ترمیم DNA خط زایا در سمت چپ شکل مشخص شده است. با این حال، چنین جهشهای ژرمینی (که باعث سندرمهای سرطانی بسیار نافذ میشوند) تنها عامل حدود 1 درصد از سرطانها هستند.
در سرطان های پراکنده، کمبود در ترمیم DNA گهگاه به دلیل جهش در ژن ترمیم DNA ایجاد می شود، اما اغلب به دلیل تغییرات اپی ژنتیکی ایجاد می شود که بیان ژن های ترمیم DNA را کاهش می دهد یا خاموش می کند. این در شکل در سطح 3 نشان داده شده است. بسیاری از مطالعات سرطان زایی ناشی از فلزات سنگین نشان می دهد که چنین فلزات سنگینی باعث کاهش بیان آنزیم های ترمیم DNA می شود که برخی از آنها از طریق مکانیسم های اپی ژنتیکی انجام می شود. مهار ترمیم DNA به عنوان یک مکانیسم غالب در سرطان زایی ناشی از فلزات سنگین پیشنهاد شده است. علاوه بر این، تغییرات اپی ژنتیکی مکرر توالیهای DNA، RNAهای کوچکی به نام microRNA (یا miRNA) را کد میکنند. miRNA ها برای پروتئین ها کد نمی کنند، اما می توانند ژن های کد کننده پروتئین و
بیان آنها را کاهش دهد.
سرطانها معمولاً از مجموعهای از جهشها و اپیموتاسیونها به وجود میآیند که یک مزیت انتخابی را به همراه میآورند که منجر به گسترش کلونال میشود (نقایص میدانی در پیشرفت به سرطان را ببینید). با این حال، جهش ها ممکن است به اندازه تغییرات اپی ژنتیکی در سرطان ها شایع نباشند. یک سرطان متوسط سینه یا روده بزرگ می تواند حدود 60 تا 70 جهش تغییر دهنده پروتئین داشته باشد که حدود سه یا چهار جهش ممکن است جهش “راننده” و بقیه ممکن است جهش “مسافری” باشند.
متاستاز
متاستاز گسترش سرطان به سایر نقاط بدن است. تومورهای پراکنده تومور متاستاتیک نامیده می شوند، در حالی که تومور اصلی تومور اولیه نامیده می شود. تقریباً همه سرطان ها می توانند متاستاز بدهند. بیشتر مرگ و میرهای ناشی از سرطان به دلیل سرطانی است که متاستاز داده است.
متاستاز در مراحل پایانی سرطان شایع است و می تواند از طریق خون یا سیستم لنفاوی یا هر دو رخ دهد. مراحل معمول در متاستاز عبارتند از تهاجم موضعی، داخل رگ به خون یا لنف، گردش خون در بدن، خارج شدن از بافت جدید، تکثیر و رگزایی. انواع مختلف سرطان تمایل به متاستاز به اندام های خاصی دارند، اما به طور کلی شایع ترین مکان هایی که متاستاز ایجاد می شود، ریه ها، کبد، مغز و استخوان ها هستند.
متابولیسم
سلول های طبیعی معمولاً تنها حدود 30 درصد انرژی را از گلیکولیز تولید می کنند، در حالی که بیشتر سرطان ها برای تولید انرژی به گلیکولیز متکی هستند (اثر Warburg). اما تعداد کمی از انواع سرطان به فسفوریلاسیون اکسیداتیو به عنوان منبع انرژی اولیه متکی هستند، از جمله لنفوم، سرطان خون و سرطان آندومتر. با این حال، حتی در این موارد، استفاده از گلیکولیز به عنوان منبع انرژی به ندرت از 60٪ فراتر می رود. برخی از سرطان ها از گلوتامین به عنوان منبع اصلی انرژی استفاده می کنند، تا حدی به این دلیل که نیتروژن مورد نیاز برای سنتز نوکلئوتید (DNA، RNA) را تامین می کند. سلول های بنیادی سرطانی اغلب از فسفوریلاسیون اکسیداتیو یا گلوتامین به عنوان منبع انرژی اولیه استفاده می کنند.
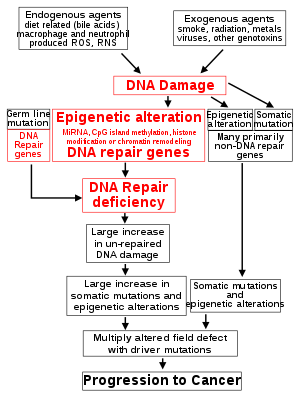
نقش اصلی آسیب DNA و نقص اپی ژنتیک در ژن های ترمیم DNA در سرطان زایی